Trastornos hormonales. Menstruación e hiperestrogenia, progesterona y menopausia
EL APARATO GINECOLÓGICO
Se puede decir que el cuerpo femenino está condicionado por la maternidad; las caderas son más anchas que las del hombre, los pechos están preparados para el amamantamiento, las características secreciones hormonales e incluso la especial sensibilidad femenina… El cuerpo de la mujer está listo desde la pubertad para la producción de óvulos que podrán ser fecundados cuando maduren y también está preparado para nutrir al nuevo ser a través de la lactancia.
El aparato ginecológico tiene su centro de control en el hipotálamo, el lugar desde el que se controlan las secreciones hormonales. Éste libera hormonas como la Hormona Liberadora de FSH y la Hormona Liberadora de LH, las cuales estimulan a la hipófisis para que segregue la FSH (estimulante del folículo) y LH (hipofisiaria Luteinizante) que estimularán a los ovarios y al útero para que comiencen el proceso del ciclo menstrual.
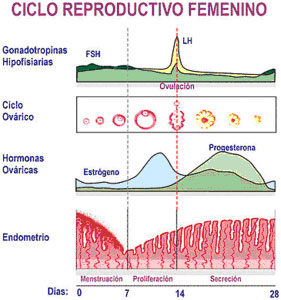
Al observar el esquema del ciclo ovárico, se aprecia que cada hormona tiene su función, y tiene picos en los que deben estar más altas o más bajas, para que todo «funcione» correctamente.
El ciclo menstrual consta de cuatro fases:
1. Menstruación (días 1 al 7): La superficie del endometrio se rompe y se convierte en un fluido de sangre que va desde el interior del útero, pasa por el cuello cervical y sale del cuerpo a través de la vagina. Una regla normal dura de 3 a 7 días.
2. El óvulo se prepara para salir del ovario (días 6 al 12): La glándula pituitaria ordena a los ovarios que desprendan estrógeno y progesterona, hormonas responsables del ciclo menstrual.
El estrógeno hace que el endometrio se engruese y prepare para alimentar y proteger el embrión. La progesterona mantiene las paredes del útero intactas hasta que la mujer queda embarazada, y durante el embarazo o hasta que comience la menstruación.
3. Ovulación (días 13 al 15): La glándula pituitaria envía una señal que hace que el cuerpo libere la hormona foliculoestimulante (FSH) y la hormona luteinizante (LH). La primera permite que los óvulos se desarrollen en el ovario, mientras que la segunda produce la liberación de uno o más óvulos maduros, los que luego entran a la trompa de falopio.
4. El revestimiento uterino se engruesa (después de la ovulación): El óvulo viaja por la trompa de falopio hacia el útero. Si no es fecundado por un espermatozoide o no se implanta, la superficie del endometrio ya no se necesita y la mucosa junto con una intrincada red de capilares sanguíneos (cuya misión es la conducción de nutrientes), se necrosará y será expulsada para ser eliminada. En ese momento el ciclo se ha completado y la menstruación comenzará nuevamente.
 La mujer puede quedar embarazada si tiene relaciones cinco días antes de la ovulación, lo cual se debe a que los espermatozoides pueden vivir en el cuerpo de la mujer de 3 a 5 días y esperar hasta el día de la ovulación para fertilizar el óvulo.
La mujer puede quedar embarazada si tiene relaciones cinco días antes de la ovulación, lo cual se debe a que los espermatozoides pueden vivir en el cuerpo de la mujer de 3 a 5 días y esperar hasta el día de la ovulación para fertilizar el óvulo.
Entonces, el periodo fértil de la mujer comprende el día de la ovulación, entre 3 a 5 días antes y 1 a 2 días después de la ovulación (el óvulo tiene un tiempo de vida de aproximadamente 24 a 48 horas).
Las hormonas principales en el proceso son los estrógenos, producidos por los folículos de los ovarios y encargados de crear el óvulo además de ser los responsables de caracteres sexuales como desarrollo de pechos y caderas con formas redondeadas. Es una hormona de proliferación y construcción, por lo que está relacionada con el aumento de la líbido y de la secreción vaginal, pudiendo una irregularidad por «exceso» ser la responsable de quistes, miomas, mastitis y mastopatías, y por defecto a falta de regla, sequedad vaginal y disminución de atributos femeninos.
La progesterona tiene como misión la creación del hábitat para el embrión y es producida por el cuerpo lúteo de los ovarios. Regula el ciclo menstrual siendo también responsable de las características femeninas.
Menstruación e hiperestrogenia
Se denomina así a los cinco primeros días del ciclo en el cual ya no se secretan estrógenos ni progesterona, el útero ya no alberga en su interior vasos sanguíneos que nutran la mucosa y ésta muere y es expulsada en forma de sangrado.
Cuando los folículos primarios que al madurar dan lugar a los óvulos se agotan, los ovarios cesan la secreción de estrógenos y progesterona y la mujer entra en el período de la menopausia.
Las cápsulas suprarrenales tienen la capacidad de producir cierta cantidad de estrógenos, pero en casos de menopausia en que la mujer es tratada con hormonas artificiales, las suprarrenales no son capaces de producirlos debido a que el tratamiento hormonal crea, como efecto secundario, una mala función de dichas glándulas.
Un problema de salud pública actual es que las niñas tienen un exceso de estrógenos o hiperestrogenia. Esto ha provocado que las niñas tengan su primera regla (menarquía) 5 años antes que hace 50 años, lo cual posibilita la aparición de enfermedades degenerativas a una edad más temprana. Entre los síntomas más característicos se encuentra:
• Acné
• Reglas irregulares y/o dolorosas.
• Síndrome premenstrual (SPM).
• Alteraciones en la cantidad de sangrado (normalmente excesivo).
• Retención de líquidos, aumento de peso, falta de concentración.
• Esterilidad.
• Dolores en la zona sacra y en las rodillas.
• Son frecuentes las cefaleas. Estos dolores normalmente aumentan o aparecen durante los días de sangrado, o previos a éste, o durante la ovulación.
• Es también muy característica la sensación de dolor o pesadez de piernas asociada a estos trastornos, que es causada por un déficit de vitaminas B; se puede suplementar estas vitaminas o levadura de cerveza, que es muy rica en ellas.
El tratamiento es a priori sencillo. Es el hígado el que se encarga de eliminar el exceso de hormonas circulantes; así pues, un hígado «sano», puede combatir la hiperestrogenia. Para conseguirlo hay que seguir una dieta levemente hipocalórica, consumir alimentos de índice glucémico bajo (es importante evitar dulces, harinas y lácteos de manera estricta); evitar vino tinto, cerdo y pollo porque contienen una gran cantidad de estrógenos; evitar alcohol y café; tomar diuréticos si existe edema: cola de caballo, té verde (1,5 l/día), ergydren; 2 cebollas pochadas/día, alcachofas, etc., como coadyudante hepático. Es fundamental la práctica regular de actividad física que regula la glucemia en sangre y mejora la expresión genética, frenando el desarrollo de nuevos receptores hormonales.
Si los síntomas son muy «graves» es interesante acompañar la dieta de suplementación: Agnus castus, ñame y aceite de onagra son los más adecuados: Bileína (2-2-2) y Ergy-yam, ambos después de la ovulación. Cuando los síntomas remitan, se puede continuar tomando Synerviol para prevenir la recidiva (también mejor después de la ovulación, porque la onagra puede causar en algunas personas molestias en la ovulación o incluso algo de sangrado). Es muy interesante el trébol rojo, que se puede alternar con milenrama. Tiene un efecto mucho más potente, sin embargo en todos los casos, la cimicifuga racemosa, pero está contraindicada en hepatopatías y riesgo de cáncer hormonodependiente.
Si con este tratamiento los síntomas no remiten, se debe conseguir identificar la fuente de «estrógenos» sintéticos que están «contaminando» a esa mujer: parabenos, bisfenol A, anticonceptivos hormonales, carnes hormonadas, tejido adiposo, exceso de fitoestrógenos como la soja, y otros aún en estudio.
La soja a dosis bajas (2-3 veces/semana) y consumida como legumbre resulta útil como alimento preventivo, sin embargo hay mucha intolerancia a esta legumbre, y a mucha gente le «sienta» mal. Una persona que ha tenido algún cáncer hormonodependiente tiene totalmente contraindicado el consumo de soja, ya que tiene cierta acción estrogénica (al igual que el vino tinto y el resto de legumbres), y en el cáncer conviene inhibir al máximo dicha acción:
Fuentes exógenas de estrógenos: El concepto de estrógeno ambiental incluye a un grupo de compuestos con estructura química diferente pero que comparten su capacidad para afectar al sistema endocrino al mimificar total o parcialmente la acción fisiológica de los estrógenos1. La ubicuidad de los EA es de tal modo que todos estamos expuestos diariamente a su actividad estrogénica, pues son muchos los alimentos o las aguas que están contaminados con compuestos residuales de estrógenos ambientales, tales como los pesticidas organoclorados, bifenilos policlorados (PCBs), y los bifenilos polibromados (PBBs). Los PCBs se han relacionado con el cáncer de hígado y de pulmón, así como con alteraciones de la función reproductiva (p.e.: impotencia). La presencia de niveles altos de PBB en sangre es un fuerte indicador de posible cáncer de mamas, de linfoma no-Hopkins o de cáncer del sistema gastrointestinal. Al igual que los pesticidas organoclorados y los PCB, los PBB sufren procesos de bioamplificación y biomagnificación a través de las cadenas tróficas (alimenticia).
Entre otras, estas sustancias parecen contribuir a la pubertad prematura, y por consiguiente, a una exposición mayor de estrógenos en la mujer2. La exposición a estrógenos por periodos largos de tiempo, durante la vida, está unida a un riesgo mayor de desarrollar cáncer dependiente de estrógeno3. La función hormonal masculina también es influida por estos tipos de compuestos.
Estudios recientes demuestran que diversos estrógenos sintéticos son cedidos en muchos casos por los materiales plásticos que conservan los alimentos como por ejemplo los contenedores donde guardamos los alimentos en el refrigerador y otras conservas, sándwiches envasados en plástico, etcétera… Se puede afirmar pues, que cada día podemos ingerir un gran número de estrógenos sintéticos de diferente estructura química.
Uno de los di-ruptores químico endocrinológico o estrógeno ambiental que más atención ha traído recientemente es el Bisfenol A, comúnmente abreviado como BPA. Este es un compuesto químico usado principalmente para hacer plásticos y lleva más de 50 años en el mercado. Su forma más común es el policarbonato de plástico, el cual es transparente y casi inastillable. Se utiliza para fabricar una gran variedad de productos incluyendo: biberones y botellas de agua, equipamiento deportivo, dispositivos médicos y dentales, compositos dentales y sellantes, anteojos orgánicos, CD y DVD, y varios electrodomésticos. Las resinas epoxi que contienen Bisfenol-A se usan como recubrimiento en casi todas las latas de comidas y bebidas. El BPA es un di-ruptor endocrinono porque actúa como un estrógeno débil. Múltiples investigaciones lo vinculan con cáncer de mamas, obesidad, diabetes y otras condiciones médicas graves4.
Al igual que el BPA los ftalatos o ésteres de ftalato son di-ruptores del funcionamiento hormonal normal al mimificar la actividad estrógenica. Este último grupo de compuestos químicos principalmente son empleados como plastificadores (sustancias añadidas a los plásticos para incrementar su flexibilidad). Los ftalatos se usan también con frecuencia en los esmaltes de uñas, adhesivos, masillas, pigmentos de pintura, juguetes de niños y en la mayoría de los juguetes sexuales. Los juguetes de niños contienen de entre 20 a 50 por cientode ftalatos del peso total del producto.
En niñas los ftalatos parecen causar pubertad precoz y un alto índice de cáncer de mamas posteriormente en la vida. En el caso de fetos masculinos, los ftalatos parecen provocar alteración en el descenso testicular, desarrollo anormal del pene y un alto índice de cáncer testicular. La responsabilidad en la prevención del cáncer de mamas no sólo recae en las mujeres, no son ellas las causantes de la inmensidad de cancerígenos ambientales.
Según IARC, 2008, Lacey et al., 2009, los factores reproductivos asociados a una exposición prolongada a estrógenos endógenos, como una menarquia precoz, una menopausia tardía y una edad madura cuando el primer parto figuran entre los factores de riesgo más importantes del cáncer de mama. Las hormonas exógenas también conllevan un mayor riesgo de cáncer de mama, por lo que las usuarias de anticonceptivos orales y de tratamientos de sustitución hormonal tienen más riesgo que las mujeres que no usan esos productos. La lactancia materna tiene un efecto protector.
Derivados de la soja: Puede ser peligroso el abuso de derivado de la soja por un estímulo excesivo de los receptores estrogénicos.
La relación del cáncer de mama con el uso de hormonoterapia de reemplazo está firmemente establecida. Diversos estudios, en especial el estudio WHI (Women’s Health Initiative), han confirmado el mayor riesgo con el aporte exógeno de estrógenos. Esto, junto a los mayores riesgos cardiovasculares de la terapia estrogénica para los trastornos climatéricos, ha llevado a la drástica reducción de sus indicaciones y uso a nivel mundial.
Sin embargo, el rol de estas hormonas en la patogénesis del cáncer de mama no se reduce a su administración exógena. Los estrógenos endógenos tienen un papel preponderante en la génesis de este cáncer, y distintas situaciones dependientes del ambiente y los hábitos de vida pueden modificar el riesgo de cáncer de mama mediado por estrógenos endógenos. El presente artículo realiza una revisión sobre el metabolismo de los estrógenos y su relación con el cáncer de mama, dado que los distintos metabolitos de los estrógenos tienen acciones biológicas diferentes y una incidencia opuesta en el riesgo de este cáncer. La ruta de metabolización hacia la 2-alfa hydroxyestrona se asocia a una reducción de 40% de desarrollar cáncer de mama. Se analiza la influencia de los cambios dietéticos en la ruta de metabolización de los estrógenos y se plantea la hipótesis de aplicar el cambio de la dieta como una de las estrategias para abatir la incidencia del cáncer de mama.
Otros estrógenos:
Los estrógenos son sintetizados a partir de precursores andrógenicos, a saber, testosterona (T) y androstenediona (A). Las enzimas que intervienen en su conversión a estrógenos constituyen un grupo de aromatasas: el grupo enzimático de los citocromos p450 (CYP). Estas enzimas se encuentran en la granulosa del ovario, el tejido adiposo, los fibroblastos de la piel, la placenta y el cerebro. El ovario es el sitio de mayor concentración y su síntesis es estimulada por la hormona folículo estimulante (FSH). En la posmenopausia, los sitios de metabolización extra-ovárico cobran importancia, fundamentalmente el tejido adiposo y la piel, por lo que la aromatización de los andrógenos está directamente relacionada al volumen de tejido adiposo presente en cada mujer. En este período (transición menopáusica) hay un cambio desde un mecanismo de producción endócrino (estrógenos de producción ovárica) a uno parácrino (síntesis tisular de estrógenos) y la fuente de los precursores andrógenicos necesarios es compartida entre el ovario y la suprarrenal. La aromatasa tisular, responsable de este último proceso, a diferencia de la ovárica no es regulada por la FSH sino por citoquinas, factores de crecimiento y glucocorticoides.
Enterolactona y enterodiol: Se ha postulado que poseen varios efectos protectores; inhibe la aromatasa y el crecimiento de células tumorales in vitro, aumenta la hormona inhibidora de hormonas sexuales sobrantes (SHBG) y, por lo tanto, los esteroides sexuales libres y actúa por retención intestinal reduciendo la circulación enterohepática de los estrógenos y sus metabolitos. El consumo de 10 gramos diarios mejora la relación 2-alfa-hydroxyestrona / 16 alfa hydroxyestrona, hacia un coeficiente acorde a un efecto de protección.
Los Receptores Estrogénicos:
Los receptores estrogénicos (RE) juegan un papel central en el proceso de activación de la transcripción génica por los estrógenos. Existen dos tipos de RE, alfa y beta, que se diferencian tanto en sus propiedades como en su distribución tisular. La estructura de ambos en cuanto a sus propiedades de reconocimiento de los estrógenos, unión al ADN y activación de la expresión génica permite suponer que actúan de manera similar (figura 1). Por ello aquí hablaremos del RE-α, que es el mejor conocido.
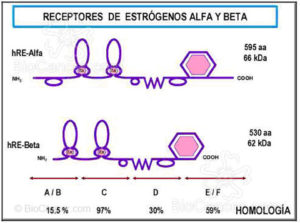
Figura 1. Comparación de los receptores estrogénicos alfa y beta. Los receptores estrogénicos alfa y beta son producto de distintos genes, pero conservan una
estructura similar.
Evidencia actual en dieta y estrógenos:
Diversos estudios buscan valorar si es posible modificar la forma de metabolización de los estrógenos mediante la dieta. Las líneas de investigación se refieren fundamentalmente a tres moléculas: indol 3 carbinol, derivados de la soja, y los lignanos (semillas de lino).
Indol 3 carbinol (I3C) -Ergycare-: es una molécula muy estudiada que se encuentra en los vegetales del grupo Cruciferous Vegetables, los más comunes para nosotros son el coliflor, el brócoli y el repollo de Bruselas. Se ha propuesto que esta molécula y su principal metabolito tienen efecto antiestrogénico y citostático. El I3C y su principal metabolito tiene efecto antitumorigénico a nivel mamario en animales. Aparentemente, el I3C induce la actividad de una isoforma de CYP (CYP 450 1A1) que lleva hacia la metabolización de 2 alfa hydroxyestrona. Existen datos obtenidos en estudios de cultivo de células de humanos que parecen contribuir con esta hipótesis.
El hábito de fumar tiene un conocido efecto protector para el desarrollo de cáncer de mama y otros tumores estrógenos dependientes. Esto se halla vinculado al mecanismo de inducción enzimática (CYP 450 1A1) que determina un metabolismo estrogénico más favorable. La «inducibilidad» de esa enzima por factores externos varía en las distintas poblaciones (polimorfismo en la expresión genética), pero aumenta con la ingestión de I3C en todas ellas (independientemente del polimorfismo), siendo el efecto más marcado en la población caucásica.
La ingesta mínima recomendada es de 100 gramos de brócoli dos veces a la semana.
Derivados de la soja -Ergyflavona-: el primer alimento candidato estudiado para explicar las diferencias interpoblacionales son los derivados de la soja. Se trata de un alimento de alto consumo en los países asiáticos, principalmente en Japón, en donde la incidencia de cáncer de mama es baja. Investigaciones realizadas en mujeres pre y posmenopáusicas demostraron que la ingesta de alimentos ricos en isoflavonas (por ejemplo, soja) aumentan la metabolización de los estrógenos a C-2-hydroxyestrona, reduciendo la concentración de C-16-hydroxyestrona. El efecto final es un aumento del cociente C-2 / C-16 y con ello una reducción del riesgo de cáncer mediado por estrógenos. Este efecto sería dosis dependiente y está determinado por el consumo moderado (promedialmente 10 mg de isoflavonas) y no por un consumo más alto. Sin embargo, otros mecanismos pueden contribuir a reducir el riesgo. La ingesta de isoflavonas es capaz de reducir los niveles circulantes de estradiol (ya mencionamos la relación de este con el cáncer de mama), efecto que se ha demostrado únicamente para pacientes premenopáusicas y que es biológicamente lógico. Por otra parte, los componentes de la soja capaces de ligarse al receptor estrogénico son la datzeina y genisteina. Se conocen dos isoformas de receptores estrogénicos: alfa y beta. Es el receptor alfa el que se relaciona generalmente con acciones proliferativas en mama y endometrio, en cambio el receptor beta se relaciona más frecuentemente con acciones antiproliferativas. Las isoflavonas tienen afinidad principalmente por el receptor beta, lo cual da otra posibilidad biológica al efecto protector. De todas formas, la actividad estrogénica de las isoflavonas es débil, 50 veces menor que el estradiol.
Otras acciones protectoras adicionales pueden estar relacionadas con cambios en la proteína que transporta esteroides sexuales en la sangre (globulina transportadora de esteroides sexuales – SHBG). Este y otros fitoquímicos podrían inhibir la aromatasa y agregar otros efectos no esteroideos eventualmente positivos, como inducir apoptosis en células cancerosas mamarias, aun en poblaciones celulares con receptores de estrógeno negativos. De todas formas, este último efecto estudiado in vitro es poco probable que se logre in vivo por las concentraciones requeridas para ello. In vitro tienen una acción sinérgica con el tamoxifeno. Para conseguir un nivel aceptable de SHBG es fundamental disminuir los niveles de insulina circulante, por lo que la laimentación debe basarse en alimentos de índice glucémico bajo, vecti-pur (1-1-1), oligoviol H (1-0-1), y practicar actividad física diaria con cambios de ritmo.
A pesar de esta evidencia los estudios clínicos prospectivos en adultos han fallado en demostrar protección del cáncer de mama con este suplemento dietético. Otros metaanálisis y estudios de casos y controles no han podido demostrar esta protección cuando es usado en la posmenopausia. Se ha postulado que para que se determine protección mamaria, la mama debe estar expuesta a estos factores en el período de desarrollo, es decir en la adolescencia, o incluso en el período del recién nacido (ya que pueden detectarse niveles significativos de flavonoides en la leche materna de mujeres asiáticas).
Lignanos – semillas de lino -Ergyline-: compuesto fundamentalmente por lignanos, se metaboliza en el intestino a enterolactona y enterodiol. Se ha postulado que poseen varios efectos protectores: inhibe la aromatasa y el crecimiento de células tumorales in vitro, aumenta la SHBG y, por lo tanto, los esteroides sexuales libres y actúa por retención intestinal reduciendo la circulación enterohepática de los estrógenos y sus metabolitos. El consumo de 10 gramos diarios mejora la relación 2-alfa-hydroxyestrona / 16 alfa hydroxyestrona, hacia un coeficiente acorde a un efecto de protección.
TRATAMIENTO
En base a todos estos datos, podemos sugerir que todas las mujeres tienen niveles mayores de estrógenos exógenos y endógenos, lo cual les está causando diversas alteraiones de salud y una disminución en su calidad de vida, además de posibles aumentos de riesgo en patologías futuras. Por lo tanto, independientemente de la sintomatología que presente la persona, parece pieza clave disminuir este nivel de «estrógenos».
1. Lo más importante es realizar actividad física aeróbica regular y a ser posible con cambios de ritmo.
2. Una dieta alcalina basada en alimentos de índice glucémico bajo, es decir una dieta tipo podría ser desayunar pan integral con aceite de oliva, fruta y vegenutril de guisante sabor chocolate; comer ensalada y proteína animal o legumbre o arroz integral o pasta de cereales ancestrales integral; cenar verdura o guisantes con algo de pescado o marisco.
3. Suplementar synerviol (1-1-1); ergyyam crema, vectipur (1-1-1) y oligoviol H (1-0-0). Zumo de granada a diario.
4. Evitar o disminuir la ingesta de carnes no ecológicas; el uso de cosméticos, champús, y demás compuestos con parabenos; evitar los recipientes de plástico, microondas, teflon, etc., por el bisfenol A; evitar el abuso de la soja.
5. Mantener el hígado en un estado óptimo de salud, siendo quizá interesante el uso de productos como supramineral desmodium, ergylixir o ergytaurina. El producto posiblemente más efectivo en este aspecto sea el ergycare, que además de ser un perfecto coadyudante hepático, posee un notable efecto antiestrogénico (indol-3-carbinol).
PROGESTERONA
La progesterona es una de las hormonas más importantes producidas por el cuerpo femenino. Suelen estar alterados los niveles por culpa de la hiperestrogenia, con lo cual es primordial tratar en primer lugar el exceso de estrógenos, pero merece la pena intentar aumentar sus niveles cuando hay claramente síntomas de deficiencia. Desempeña un papel crítico en estimular y regular varias funciones dentro del cuerpo. La progesterona es una hormona fundamental que es también responsable de la producción de hormonas adicionales tales como estrógeno y cortisona. Tiene otras funciones importantes dentro del cuerpo incluyendo:
- Regula la glándula de tiroides y modera los efectos negativos de la dominación del estrógeno sobre el funcionamiento de la tiroides, de tal modo previniendo síntomas de hipotiroidismo.
- Mejora el sistema inmune.
- Reduce la hinchazón e inflamación.
- Mantiene niveles de coagulación de sangre estables.
- Estimula la producción del colágeno que aumenta la elasticidad de la piel.
- Mantiene los huesos y los músculos fuertes.
- Ayuda a mantener los nervios y a protegerlos contra el deterioro.
Una deficiencia en progesterona daría por tanto una serie de síntomas clínicos que pueden ser uno o varios de los siguientes: ciclos menstruales irregulares (más largos de lo normal); síndrome premenstrual; dolores de cabeza durante el ciclo y/o la ovulación; cansancio; tendencia al bajón anímico o depresión; plaquetas bajas; baja temperatura corporal; síntomas alérgicos; esterilidad; etc.
Síndrome premenstrual:
Como el diagnóstico de SINDROME PREMENSTRUAL, generalmente no se formula, los síntomas psíquicos son atribuidos a cuadros de neurosis o enfermedad depresiva, y se consulta a un psiquiatra. Por la cefalea y jaqueca, al neurólogo. Por las alteraciones menstruales, flujo crónico, dolores menstruales y pelvianos, al ginecólogo. Por la distensión abdominal y molestias digestivas, al gastroenterólogo, atribuyéndose por lo general al COLON IRRITABLE. Por los dolores lumbosacros, al traumatólogo o kinesiólogo, atribuyéndose a afecciones de columna. Por las molestias mamarias premenstruales, al especialista en mamas. Por los síntomas urinarios premenstruales, al urólogo. Por los problemas inmuno-alérgicos premenstruales, herpes simple, sequedad de la piel, manchas pigmentadas faciales, mayor caída del cabello, uñas quebradizas, acné de exacerbación premenstrual, al dermatólogo, inmunólogo, cosmetóloga.
De lo anterior se desprende la gran importancia de efectuar una completa y minuciosa historia clínica que nos lleve a un diagnóstico integral, a fin de que se investiguen los factores etiológicos o causales de esta compleja patología que afecta FRECUENTEMENTE a la mujer.
Progestágenos: Las hierbas tales como Vitex agnus-castus (Sauzgatillo) mejoran niveles de la progesterona así como promueven el equilibrio y la salud hormonales.
Es interesante para aumentar los niveles de progesterona también el ñame (ergy-yam); un cereal andino llamado maca y la pulsatilla (homeopático) a la 200 CH, una dosis semanal.
Además, Eleutherococcus senticosis (Ginseng siberiano) promueve el funcionamiento sistémico total del sistema reproductivo femenino, actuando como tónico para la salud y la fertilidad femeninas.
Es preciso añadir que todos estos progestágenos no tienen una función clara en el metabolismo hormonal. Parece que actúan incorporándose areceptores de progesterona por lo que en las situaciones en las que hay carencia, ayudarían a aumentar el nivel de progesterona, y en las situaciones en las que hay exceso podrían intervenir disminuyendo el nivel de progesterona, bloqueando los receptores disminuyendo su función. Actuarían pues, como los fitoestrógenos y los receptores estrogénicos. En clínica esto se traduce en una regulación del nivel hormonal en todos los casos, pero debido a que no hay dos personas iguales, no podemos saber cómo va a tolerar estos progestágenos y en el caso de notar un aumento de sus síntomas u otros síntomas adversos, sería mejor cambiar el tipo de suplemento.
Ovarios poliquísticos = Síndrome metabólico = Hipotiroidismo = Sobrepeso = Diabetes tipo 2 = Dislipidemias??
Cuando los ovarios son poliquísticos hay una disfunción en la hipófisis secundaria a un exceso de insulina en sangre. La fisiopatogenia se desconoce, sin embargo se sabe que es una de las enfermedades del Síndrome Metabólico. Como consecuencia todas las hormonas están más elevadas excepto la progesterona que se encuentra en unos niveles muy bajos con respecto a las demás. Según qué hormona esté más elevada, la mujer puede desarrollar alteraciones asociadas a hiperestrogenia (edemas, sangrado abundante, síndrome premenstrual); o lo que es más habitual, alteraciones asociadas a exceso de andrógenos como la testosterona (musculatura excesivamente desarrollada, vello facial marcado, etc). En todos los casos la progesterona está baja, y ésta es la encargada de producir la ovulación; dicha ovulación no se produce, el óvulo se enquista y la mujer no tiene la regla o ésta se retrasa mucho tiempo.
Los síntomas más característicos son cambios en apariencia, patrones anormales de menstruación y desórdenes metabólicos.
El síndrome de ovario poliquístico (SOP), también denominado hiperandrogenismo ovárico funcional o anovulación crónica hiperandrogénica, es una disfunción endocrino-metabólica de alta prevalencia (5-10%), de etiología incierta y que se encuentra en estrecha asociación a resistencia a la insulina y a la diabetes 2. De hecho, la mayoría de estas pacientes presentan algún grado de resistencia a la insulina; el 40% de ellas desarrollan intolerancia a la glucosa y el 16% diabetes 2 al final de la cuarta década de la vida.
A pesar de que hay mujeres que presentan quistes en los ovarios (el óvulo sigue creciendo y debido a la ausencia de progesterona, no se produce la ovulación con lo cual se enquista), el 40% de los casos tenían ovarios de tamaño normal y 46% no presentaban engrosamiento de la túnica albugínea. Un estudio posterior demostró que el síndrome clínico podía asociarse a ovarios de morfología aparentemente normal, y otro reciente establece que 16-25% de las mujeres sanas podían presentar imágenes ultrasonográficas sugerentes de ovarios poliquísticos sin el síndrome clínico.
DIAGNÓSTICO
El diagnóstico del SOP se basa en la combinación de irregularidad menstrual (oligomenorrea o amenorrea por anovulación crónica), hiperandrogenismo clínico (hirsutismo, acné, seborrea) o de laboratorio (aumento de andrógenos circulantes) y ausencia de otras causas específicas de hiperandrogenismo adrenal o hipofisiario. La ecografía sugerente de SOP (presencia de múltiples imágenes quísticas de 2-4 mm, asociadas a un incremento del estroma en un ovario de tamaño normal o aumentado) es un elemento coadyuvante y su normalidad no descarta el diagnóstico. Los métodos para establecer resistencia a la insulina, más que el diagnóstico son útiles para definir el tipo de SOP.
Es interesante hacer notar que si bien por muchos años se utilizó el aumento de la relación LH/FSH para el diagnóstico del SOP, en la actualidad este parámetro no es estrictamente necesario, ya que puede haber mujeres con SOP y relación LH/FSH normal, especialmente cuando son obesas.
RIESGO DE ENFERMEDADES METABÓLICAS ASOCIADAS A LA RESISTANCIA A LA INSULINA
El eje central de la enfermedad metabólica de estas pacientes es la resistencia a la insulina, que está presente en la mayoría de las pacientes SOP. La resistencia a la insulina asociada a otros factores genéticos, dieta rica en grasas saturadas, obesidad androide e inactividad física condicionan el desarrollo de hipertensión arterial, dislipidemia, intolerancia a la glucosa y diabetes 2 las que pueden presentarse a edades más tempranas que en la población general (3ª-4ª década) e inciden en el desarrollo precoz de enfermedad cardiovascular.
Característicamente las mujeres con SOP presentan una disminución de colesterol HDL 2 y apolipoproteína A-I y un aumento muy significativo de triglicéridos; además presentan un aumento significativo, aunque menor, de colesterol total y colesterol LDL, en comparación a mujeres control pareadas por peso corporal. Se ha sugerido que la alteración más característica del perfil lipídico sería la disminución de los niveles de HDL-2. Es probable que el hiperandrogenismo juegue un rol en la dislipidemia de estas pacientes, pero sin duda, la hiperinsulinemia tiene el efecto más preponderante.
HIPERINSULINEMIA
La insulina interviene en procesos como:
– Evitar pérdida de proteínas, conservación de la masa muscular.
– Estimular la síntesis de ácidos grasos.
– Impedir la utilización de ácidos grasos como fuente de energía.
– Estimular la desaturación de ácidos grasos.
– Favorecer la entrada de aminoácidos en el tejido muscular, especialmente los aminoácidos de cadena ramificada (Leucina, valina e isoleucina)
– Estimula el crecimiento de tejidos en general.
– Estimula la producción de andrógenos en la mujer.
Es este último punto el que interesante para poder comprender muchas de las manifestaciones observadas en el síndrome del ovario poliquístico. Las mujeres con SOP presentan insulinorresistencia con lo que la insulina es demasiado alta en sangre y se crean demasiados andrógenos (como testosterona). Esta testosterona se crea a partir de la progesterona, con lo que según van aumentando los andrógenos, va disminuyendo la progesterona, y las complicaciones se multiplican. El exceso de insulina en ovario estimula la secreción de testosterona al activar la desmolasa y asimismo aumenta la secreción de LH y la sensibilidad a la ACTH en la corteza suprarrenal, hormonas hipofisarias que regulan la secreción de esteroides en adrenales y gónadas. También el exceso de insulina en adipocito estimula la síntesis de ácidos grasos y favorece la obesidad, especialmente abdominal.
Sin un tratamiento nutricional adecuado no se podrá revertir esta situación. Es fundamental reducir los niveles de insulina con una dieta óptima, adaptada a cada persona de manera individual.
Actualmente numerosos autores proponen reducir consumo carbohidratos, lo cual ciertamente es efectivo para hacer descender los niveles de insulina pero no es la única manera. Existen dos métodos efectivos para hacer descender los niveles de insulina y glucosa en sangre y aumentar la sensibilidad a la insulina. Uno de ellos es la llamada dieta de la zona, el otro sería una dieta vegana restringida en proteínas, especialmente metionina.
TRATAMIENTO
El tratamiento debe estar orientado a corregir el hiperandrogenismo, la anovulación crónica y las alteraciones metabólicas asociadas a resistencia a la insulina y al hiperinsulinismo. En primer lugar, debe combatirse la obesidad mediante dieta y ejercicio físico regular. La obesidad agrava la resistencia a la insulina y las alteraciones metabólicas derivadas de la hiperinsulinemia y agrava aspectos reproductivos del síndrome como hiperandrogenismo, anovulación crónica, complicaciones obstétricas y mayor incidencia de cánceres con dependencia hormonal. Su tratamiento disminuye la hiperinsulinemia y puede atenuar las alteraciones metabólicas asociadas; disminuye los niveles de testosterona y LH permitiendo la reanudación espontánea de la ciclicidad ovárica y de la ovulación o, en caso contrario, aumenta la sensibilidad a los inductores de ovulación.
Actividad física aeróbica: 1 hora/día.
En segundo lugar es fundamental conocer que en la mayoría de los casos los síntomas negativos aparecen o se exacerban durante un momento de estrés importante porque aumenta el cortisol, y el cortisol produce precisamente un estímulo fuerte en las glándulas suprarrenales, que a su vez producen un gran aumento de glucosa en sangre.
Dormir 8 horas en total, si hiciera falta, puede suplementarse:
Bicebe (1-0-0)
Ergymag (0-0-2)
Vecti-seren (0-0-1)
El tratamiento es el mismo que para el de una persona con Síndrome Metabólico: dieta de índice glucémico bajo. Muchos autores proponen reducir o eliminar el consumo de hidratos de carbono, lo cual es efectivo en muchos casos pero pueden aparecer otras complicaciones, asociadas a un exceso de proteína, una falta de fibra insoluble, etc. Por eso la propuesta nutricional aquí planteada es la siguiente:
– Desayuno: Vegenutril de guisante sabor chocolate. Copos de avena cocidos o pan germinado con aceite de oliva. Es posible añadir algo de fruta, frutos secos crudos y/o un yogur ecológico con semillas de lino, calabaza, goji, girasol, etc.
– Comida: Siempre verdura o ensalada de primero y de segundo 2 días legumbre; 1 día pasta integral; 2 días carne magra; 1 día pescado; 1 día huevo.
– Merienda: Los alimentos del desayuno, siempre después de haber practicado una hora de actividad física.
– Cena: Puré de verdura con trigo sarraceno o quinoa. Algo de pescado o marisco.
Además para ayudar a la ovulación se puede suplementar aceite de onagra a grandes dosis -Bileína (2-2-2)-; para disminuir la glucosa en sangre y por tanto la insulina, es muy interesante Vecti-pur (1-1-1) y Oligoviol H (1-0-0) y para ayudar a aumentar la progesterona se puede suplementar Agnus Castus (Sauzgatillo); ñame; y/o una cucharada diaria de ajo, perejil y limón. También es recomendable la maca. Además sería muy interesante añadir Ergytaurina (1-1-0), ya que actúa como antioxidante de la bileína, y además es fundamental para la síntesis de sales biliares, y aumenta la excreción de esteroides como el colesterol, la testosterona y el estradiol, los cuáles se hallan elevados en los casos de SOP. Por tanto la ingestión de taurina es una forma fácil de eliminar el exceso de testosterona. La taurina también, al ser un poderoso antioxidante disminuye la resistencia a la insulina, por lo que su ingesta aumenta la eficacia con la que las células captan la glucosa del torrente circulatorio, y producen por tanto una acción hipoglucemiante.
Ovarios poliquísticos y trastornos emocionales:
Es característico que las mujeres con ovarios poliquísticos tengan una intolerancia a la glucosa. Es el tema más complejo de solucionar puesto que es preciso conseguir una normoglicemia mantenida a lo largo del día. En el caso de consumir alimentos de índice glucémico alto, se va a producir una hipoglucemia reactiva secundaria a la secreción de insulina. Y en el caso de dietas hipocalóricas, hiperproteicas o sin cereales ni legumbres, la glucemia se mantendría demasiado baja. Cuando la glucemia se encuentra por debajo de lo normal aparecen una serie de síntomas calificados en la mayoría de las ocasiones, como ansiedad: Ahogo, palpitaciones, sensación de desmayo, mareo o inestabilidad, sofocos, sudoración, sensación de hormigueo o entumecimiento en las extremidades, temblor, nauseas, miedo intenso, sensación de irrealidad, confusión mental, nerviosismo, incoordinación…
Hipoglucemia reactiva
El nivel de glucosa en sangre de una persona hipoglucémica sube después de las comidas y tiene una descenso significativamente más bajo de lo normal al cabo de entre 2 y 5 horas. La glucosa es el alimento principal del cerebro y del sistema nervioso. Ninguno puede sintetizarla o guardarla. Así pues, si la concentración de glucosa en sangre baja a un nivel crítico, tanto el sistema nervioso como el cerebro se verán afectados causando un sinfín de síntomas.
Los síntomas de la hipoglucemia reactiva están divididos en dos grandes grupos. Los síntomas neuroglicopénicos, causados cuando el cerebro no recibe suficiente cantidad de glucosa; y los síntomas neurogénicos, que se manifiestan cuando las glándulas suprarrenales producen adrenalina y noradrenalina, con el fin de volver a subir los niveles de glucosa de la sangre.
Síntomas neuroglucopénicos:
Debilidad, llanto, angustia, visión borrosa, confusión, fatiga, irritabilidad, pánico, nerviosismo, falta de concentración, incoordinación, depresión.
Síntomas neurogénicos:
Sudor, sofoco, taquicardia, mareos, nausea, temblores, vértigo, sensación de pánico y miedo, ansiedad, dolores de cabeza, espasmos intestinales, ahogo, sensación de hormigueo.
Estos síntomas suelen ser episódicos, y se relacionan con el tiempo transcurrido y el contenido de la comida previa. Normalmente, mejoran al comer. Tienen su razón de ser: en circunstancias normales la glucosa de la sangre se mantiene dentro de un margen de variación bastante estrecho controlado por diferentes hormonas, las cuales responden rápidamente al menor cambio. Con la ingesta y metabolismo de carbohidratos (verduras, ensaladas, cereales…), los niveles de glucosa en la sangre aumentan de forma constante, activando la producción de una cantidad moderada de insulina. Ésta disminuye paulatinamente los niveles de glucosa escoltándola, por un lado, a las células, y, por otro, enviándola al hígado y los músculos para ser almacenada.
El hipotálamo cuando siente el bajón de glucosa, activa el Sistema Nervioso Autónomo, a través del cual se segregan catecolaminas (adrenalina y noradrenalina, principalmente). Estas hormonas estimulan la salida del glucógeno almacenado, lo cual produce un aumento de los niveles de glucosa. Esta producción de catecolaminas es la causante de los síntomas neurogénicos. También tienen la capacidad de estimular las glándulas suprarrenales, el tabaco y el café.
Por otro lado, un alto porcentaje de síntomas del Síndrome Premenstrual están causados por una excesiva cantidad de estrógenos y, por el contrario, unos niveles bajos de progesterona. Ambas hormonas controlan los niveles de glucosa, por lo tanto, cualquier desequilibrio entre ellas puede fácilmente producir hipoglucemia reactiva. La adrenalina se forma a través de la progesterona, con lo cual una deficiencia de ésta puede fácilmente ralentizar la subida de glucosa causando hipoglucemia reactiva.
La píldora anticonceptiva también parece afectar los niveles de glucosa. El Dr. Wayne Huey-Heng shey llevó a cabo un estudio de investigación publicado en Clinical Endocrinology en 1994, que demuestra que la píldora anticonceptiva tomada durante al menos 3 meses produce intolerancia a la glucosa.
Ataques de pánico por la noche: los peores momentos de las crisis de miedos son durante la noche y a primera hora de la mañana. Esto es debido a que la glucosa llega a su pico más bajo justamente en esos momentos, normalmente cuando la persona lleva sin comer alrededor de 8 ó 10 horas.
A las enfermedades mentales se les llama diabetes tipo 3; casualmente todas tienen en común que tienen la glucosa baja. Ahora se sabe que la glucosa está baja porque hay una intolerancia a la glucosa; se intenta eliminar de la sangre porque es tóxica pero la que hay en sangre actúa como un antígeno y el sistema inmune ataca.
Pero el sistema inmune se equivoca lo mismo que ataca a los pulmones a los intolerantes a la lactosa en este caso ataca al eje hipófisis-hipotálamo produciendo resistencia insulina, ovarios poliquísticos, depresión… Es un círculo vicioso.
Siempre que hay una intolerancia, el hígado es el que determina la salud de la persona. Si el hígado es capaz de metabolizar aquello a lo que una persona es intolerante, la persona ni se entera de la intolerancia. Si no es capaz…
Y ahí, un virus como el epstein barr podría desencadenar el inicio o el empeoramiento de la sintomatología por el daño hepático que conlleva.
Por eso se mejora enseguida con la dieta de desintoxicación hepática y con la ergytaurina.
¡¡¡Y por eso se mejora muchísimo al quitar el gluten!!!
Tratamiento:
– Eliminar azúcares, lácteos y cereales de momento; también patata, zumos, miel y todo lo que tenga índice glucémico alto.
– Comer: verdura, legumbre, pescado, carne, huevo, frutos secos, semillas y 2 piezas de fruta (fruta ácida). Desayunar: copos de avena cocidos porque también necesitamos algo de fibra insoluble. Y vegenutril de guisante sabor chocolate si se tolera bien.
Suplementar: Ergytaurina (2-0-0); bileína (1-1-1); naturalkyl (1-1-1); ergyphilus confort (2-0-0); vectipur (1-1-1); oligoviol H (1-0-1) y siempre que se coma más cantidad de alimentos de índice glucémico más alto; bicebe (0-1-0). Será necesario tomar mayor número de suplementos en función de la gravedad del cuadro o de que no se regulen los ciclos menstruales. Todos estos suplementos tienen la misión de regular la glucemia en sangre, la intolerancia, el hígado y las hormonas. Si los ciclos no se regulan, se debe administrar algún progestágeno.
Hasta encontrarse GENIAL.
Luego se va quitando poco a poco toda la suplementación.
El día que una persona se salte la dieta o beba alcohol o esté más estresada, se puede tomar ergytaurina y bicebe que van a paliar esa intolerancia.
EJERCICIO
Se recomienda seguir una rutina de ejercicio suave. Como ya se ha explicado, se sabe que éste ayuda a mantener unos niveles óptimos hormonales, además de ayudar a que la glucosa entre mejor en las células aumentando la energía, sin requerir insulina. Es importante practicar una hora de actividad física diaria, aunque sea caminar.
MENOPAUSIA
La Menopausia es una bajada brusca de las hormonas femeninas, que tienen que mantener cierto nivel en sangre. La función de producir hormonas la asume las glándulas suprarrenales. Cuando existe cualquier alteración metabólica en la mujer, es fácil que la menopausia se vea acompañada de síntomas variados: retención de líquidos, sofocos, insomnio, depresión, diversos dolores osteomusculares, etc.
Una Dieta Básica Sana regula el metabolismo, provocando la mayoría de las veces que la mujer vuelva a tener la menstruación. Una suplementación muy adecuada para evitar los trastornos es el aceite de onagra, el ergyyam y/o las isoflavonas.
Los nutrientes más importantes en este período son:
• Ácidos grasos omega 3: para reducir el riesgo de formación de trombos o coágulos, y control colesterol. Los alimentos ricos en estos ácidos son los pescados azules (sardina, arenque, anchoa y salmón), algunos aceites de semillas, como el de girasol, o los frutos secos (nueces o almendras).
• Antioxidantes: Alimentos ricos en vitamina E (aceites de semillas y de oliva no refinado, frutos secos, germen de trigo), en vitamina C (cítricos, kiwi, pimiento, tomate, etc.), beta-caroteno (zanahoria, melocotón, calabaza, etc.), zinc (carnes, pescados, huevos), selenio (nueces de Brasil, carnes, pescados, marisco, etc.), polifenoles (vegetales en general) y compuestos de azufre (verduras de la familia de la col, cebollas, ajos, etc.).
• Fitoesteroles: son esteroles de origen vegetal que presentan una estructura similar al colesterol: soja, semillas de calabaza, almendras y nueces.
• Ácido linoleico conjugado (CLA): Aceites de semillas y en grasas animales, sobre todo en la leche de los rumiantes. Aumenta la lipólisis (degradación de grasas) y disminuye la lipogénesis (síntesis de grasas) y la captación de los ácidos grasos por el organismo, con la consiguiente disminución de la cantidad de grasa corporal. También podría tener un cierto papel reductor de las concentraciones sanguíneas de triglicéridos y colesterol.
• Fitoestrógenos: Son agonistas parciales de los receptores de estrógenos, tienen efectos beneficiosos en el tejido óseo (reduciendo la osteoporosis) y en la mama y próstata (disminuyendo la incidencia de cáncer); además, pueden mejorar la sintomatología asociada al climaterio (sofocos, irritabilidad, etc.) y tener efectos positivos sobre el sistema cardiovascular. Fuentes importantes de Fitoestrógenos son el ajo, la frambuesa, las legumbres y la soja. Además las legumbres son alimentos de bajo contenido graso, constituyen una buena fuente de proteínas (14 g/ración en el caso de la soja), gran cantidad de fibra (1 g/ración), con efecto antioxidante. También hay fitoestrógenos en la alfalfa (Medicago sativa), angélica (Angelica archangelica), salvia (Salvia officinalis), o la borraja (Borago officinalis).
• Vitamina D: muy interesante es el consumo de pescados azules, tanto por su contenido en ácidos grasos omega-3 como en vitamina D, y de productos lácteos desnatados enriquecidos con calcio y vitaminas A y D, si no existe intolerancia, aunque sería preferible un suplemento como el ergyóseo (2-0-0).
• Sustancias con propiedades remineralizantes: como algunas plantas ricas en minerales, sobretodo en silicio, que se utilizan en procesos degenerativos como la osteoporosis o en casos de fracturas. Las más utilizadas son la cola de caballo (Equisetum arvense), la alfalfa (Medicago sativa) y la ortiga (Urtica urens). En casos de osteoporosis también se recomienda como preventivo el uso de plantas con acción estrogénica, como la soja o la onagra.
Las hormonas son elementos químicos elaborados por el organismo a través de las llamadas glándulas endocrinas que están repartidas por el cuerpo. Las hormonas tienen una función reguladora del equilibrio orgánico en múltiples aspectos del cuerpo y la mente. Por lo que los problemas hormonales pueden presentarse en diferentes aspectos físicos, mentales o emocionales.
Así que cualquier trastorno hormonal, bien por exceso (hiperfunción) o por defecto (hipofunción), es un desequilibrio para el pleno funcionamiento del organismo, lo que a veces se refleja en cuestiones muy evidentes y otras veces de forma soterrada.
Síntomas de trastornos hormonales en los hombres:
• Problemas en la piel (acné, sarpullidos, pequeñas decoloraciones, etc.)
• Pérdida del cabello repentina y rápida.
• Pérdida o aumento de peso súbito.
• Problemas oculares.
• Cambios de humor.
• Impotencia.
• Depresión.
Síntomas de trastornos hormonales en las mujeres
• Problemas de la piel (acné, sarpullidos, pequeñas decoloraciones, etc.)
• Flujo vaginal y/o hemorragia menstrual abundante o muy larga.
• Cambio de carácter, mal humor, tristeza sin motivo aparente.
• Dolor en la cintura con inflamación en el bajo abdomen.
• Dolor o sangrado vaginal en las relaciones sexuales.
• Cólicos menstruales y/u olor intenso de la misma.
• Menstruaciones irregulares o ausencia de ellas.
• Coágulos en los sangrados menstruales.
• Dolor en el bajo vientre o en los ovarios.
• Manchado oscuro después del período.
Tipos de trastornos o problemas hormonales
• Hipertiroidismo: es un problema hormonal metabólico en el cual la glándula endocrina tiroides produce muchas más hormonas tiroideas de las necesarias provocando una serie de trastornos importantes.
• Bocio hipofuncionante: este trastorno hormonal es un problema también de la tiroides. En este caso por una baja producción de hormonas tiroideas, produciendo, entre otras cosas, el bocio, bulto característico en el cuello.
• Desequilibrio de estrógenos: este trastorno hormonal afecta a las mujeres y cada vez hay más casos de exceso o desequilibrio de estrógenos.
• Exceso de cortisol: es la hormona del estrés ya que éste lo genera. En este caso es un síntoma que se convierte en un círculo vicioso si no se trata.
• Exceso de adrenalina: no es tanto un trastorno hormonal o de las glándulas endocrinas, como del comportamiento, lo que puede tener consecuencias negativas para el organismo.
• Los esteroides: al igual que el caso anterior, tampoco es un problema hormonal sino un mal hábito. Algunos atletas y otras personas usan esteroides anabólicos para mejorar su desempeño y apariencia física, lo que puede producir graves trastornos hormonales.
POSIBLE DIETA DURANTE LA MENOPAUSIA
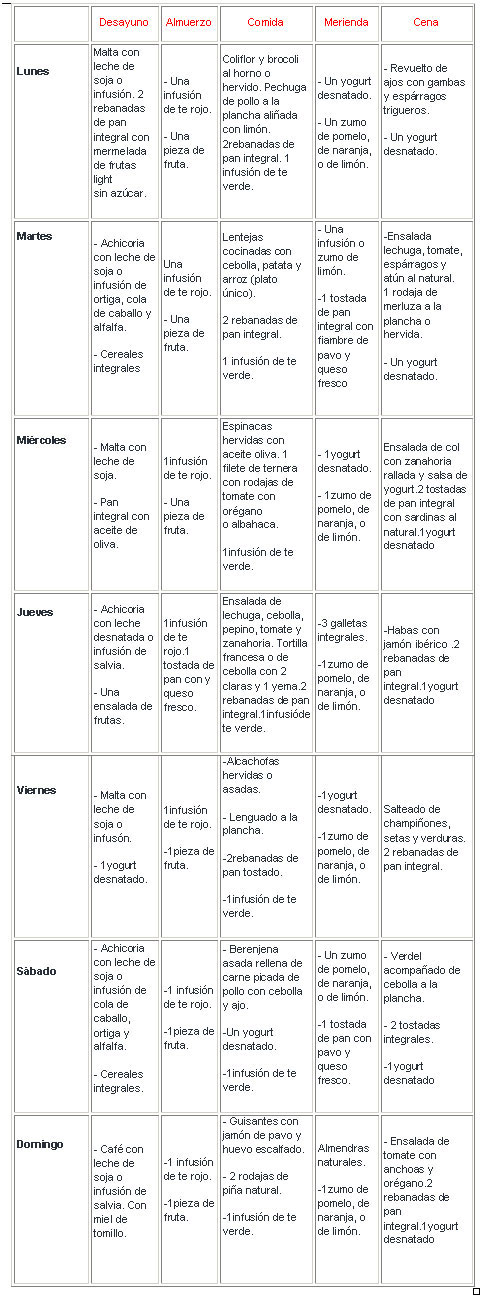
Mediante la dieta propuesta, al haber un porcentaje bajo de grasa saturada, no alimentos fritos, poco pan, lácteos desnatados, mucha verdura, no más de 2-3 piezas de fruta, es muy fácil conseguir que las calorías no excedan de 1900; luego habría que proponer los gramos de nutrientes adecuados para conseguir las cantidades recomendadas de 250 g de hidratos de carbono; 50 g de proteínas y 63 g de lípidos.
Se recomiendan 10 g diarios de hierro: carnes, huevo, pan, pescado, legumbres, pero sobre todo las carnes que nos aseguran esa fuente de hierro, sobre todo porque es hierro HEM, y no hay postre lácteo para evitar la absorción.
Con los lácteos aunque sean de soja, coles, huevos y pescado, aseguramos el aporte de calcio. Sí sería interesante que la leche de soja tuviera un aporte extra de calcio. Y además el consumo de pescado azul nos aporta la vitamina D, y aconsejar a que la persona salga a pasear y le dé el «sol». No parece adecuado aumentar excesivamente la cantidad de leche y derivados, ya que aún hay una gran controversia y no está claro si los lácteos de vaca previenen o incrementan la osteoporosis. En noviembre de 2004, se ha publicado un estudio en el que se observa que, a mayor consumo de lácteos, mayor eliminación de calcio (Prynne CJ, et al. Dietary acid-base balance and intake of bone-related nutrients in Cambridge teenagers. European Journal of Clinical Nutrition. November 2004, Volume 58, Number 11, Pages 1462-1471)
DATOS INTERESANTES SOBRE LA SOJA:
Alteraciones endocrinas. En estudios que datan de la década de los 50 del siglo pasado ya se demostró que la soja causa trastornos endocrinos en animales». Y entre esas alteraciones endocrinas cita alteraciones del páncreas («los niños alimentados con fórmulas de soja tienen el doble de diabetes») y alteraciones del tiroides («la soja contiene sustancias que debilitan la función de la glándula tiroides • Es bociógena. La genisteína es un inhibidor de la peroxidasa tiroidea más poderoso que los medicamentos normales anti-tiroideos»). Y añade que «se ha descrito aumento de la TSH hipofisiaria (siglas en inglés de la hormona tirotropina) en respuesta a su acción antitiroidea, bocio difuso, hipotiroidismo (con sus síntomas asociados: estreñimiento, letargia, fatiga, etc,), tiroiditis autoinmune subaguda (los niños alimentados con fórmulas a base de soja tiene el triple de enfermedades autoinmunes del tiroides, según un estudio del Departamento de Pediatría del Hospital Universitario Cornell de North Shore Manaste, Nueva Cork , Estados Unidos) y hasta cáncer de tiroides». Continúa luego explicando Embid en su artículo que al inhibir la peroxidasa tiroidea -necesaria para fabricar las hormonas tiroideas T3-T4- «la genisteína causa daño irreversible a las enzimas que sintetizan las hormonas de la tiroides».
Otro dato relevante a este respecto es que ya en 1988 el doctor Theodore Kay de la Facultad de Medicina de la Universidad de Kyoto (Japón), señalaría que «sabemos desde hace medio siglo que las ratas y los humanos alimentados con soja -especialmente los niños y las mujeres- sufren agrandamientos de la tiroides».
Asimismo, dentro de estas posibles alteraciones endocrinas que podría provocar la soja no fermentada Alfredo Embid recuerda que «contiene fitoestrógenos cuya acción se puede combinar con otros disruptores endocrinos y xenoestrógenos responsables de alteraciones en las hormonas sexuales, alteraciones del comportamiento sexual, aparición de la pubertad precoz, anomalías congénitas del tracto genital masculino (de hecho, como publica el Soy Online Service, la mayor incidencia de este tipo de defectos se ha registrado en bebés varones nacidos de madres vegetarianas consumidoras de soja), disminución de la fertilidad y disminución de andrógenos». A lo que habría que sumar que «hay pruebas de que las isoflavonas de la soja genisteína y daidzeína son genotóxicas para el esperma humano», aunque también hay evidencia refutada de que es anticancerígena.
BIBLIOGRAFÍA
1. Barrios E, Ronco A, Fierro L, De-Stéfani E, Vassallo J. Tendencias de la mortalidad por cáncer en Uruguay 1953-1997. Rev Med Uruguay 2002; 18: 167-74.
2. Ministerio de Salud Pública (Uruguay). División Estadística. Mortalidad clasificada por causa, sexo y edad. Montevideo. Montevideo: MSP, 1998.
3. De-Stéfani E, Fierro L, Barrios E, Ronco A. Cancer Mortality Trends in Uruguay, 1953-91. Int J Cancer 1994; 56(5): 634-9.
4. Writing Group for the Woman Health Initiative Investigators. Risks and Benefits of Estrogen Plus Progestin in Healthy Postmenopausal Woman. Principal results from the Women´s Health Initiative Randomized Controlled Trial. JAMA 2002; 288(3): 321-33.
5. Million Women Study Collborators. Breast cancer and hormone-replacement therapy in the Million Women Study. Lancet 2003, 2(362): 419-27.
6. Collaborative Group on Hormonal Factors in Breast Cancer. Breast cancer and hormone replacement therapy: collaborative re analysis of data from 51 epidemiological studies of 52.705 women with breast cancer and 108.411 women without breast cancer. Lancet 1997; 350(9084): 1047-59.
7. International Agency for Research on Cancer. Sex hormones (II). In: IARC Monographs on the Evaluation of the Carcinogenic Risk of Chemicals to Humans. 1976 Vol 21. Lyon, France. Last updated: 6 April 1998. Obtenido de: http://monographs.iarc.fr/htdocs/indexes/vol21index.html. Fecha acceso: septiembre de 2004.
8. Clemons M, Goss P. Estrogen and the risk of breast cancer. N Engl J Med 2001; 344(23): 276-85.
9. Fuchs-Young R, Glasebrook AL, Short LL, Draper MW, Rippy MK, Cole HW, et al. Raloxifene is a tissue-selective agonist/antagonist that functions through the estrogen receptor. Ann N Y Acad Sci 1995; 761: 355-60.
10. Russo J, Lareef MH, Tahin Q, Hu YF, Slater C, Ao X, et al. 17 Beta-estradiol is carcinogenic in human breast epithelial cells. J Steroid Biochem Mol Biol 2002; 80(2): 149-62.
11. Liehr JG. Genotoxicity of the steroidal oestrogens oestrone and oestradiol: possible mechanism of uterine and mammary cancer development. Hum Reprod Update 2001; 7(3): 273-81.
12. Simpson ER, Mahendroo MS, Means GD, Kilgore MW, Hinshelwood MM, Graham-Lorence S, et al. Aromatase cytochrome P450, the enzyme responsible for estrogen biosynthesis. Endocr Rev 1994; 15: 342-55.
13. Dunn LJ, Bradbury JT. Endocrine factors in endometrial carcinoma: a preliminary report. Am J Obstet Gynecol 1967; 97: 465-71.
14. Ackerman GE, Smith ME, Mendelson CR, MacDonald PC, Simpson ER. Aromatization of androstenedione by human adipose tissue stromal cells in monolayer culture. J Clin Endocrinol Metab 1981; 53: 412-7.
15. Simpson ER, Rubin G, Clyne C, Robertson K, O’Donnell, L, Jones M, et al. The role of local estrogen biosynthesis in males and females. Trends Endocrinol Metab 2000; 11: 184-8.
16. Bulun SE, Simpson ER, Word RA. Expression of the CYP19 gene and its product aromatase cytochrome P450 in human leiomyoma tissues and cells in culture. J Clin Endocrinol Metab 1994; 78: 736-43.
17. Noble LS, Simpson ER, Johns A, Bulun SE. Aromatase expression inendometriosis. J Clin Endocrinol Metab 1996; 81: 174-9.
18. Bulun SE, Price TM, Mahendroo MS, Aitken J, Simpson ER. A link between breast cancer and local estrogen biosynthesis suggested by quantification of breast adipose tissue aromatase cytochrome P450 transcripts using competitive polymerase chain reaction after reverse transcription. J Clin Endocrinol Metab 1993; 77: 1622-8.
19. Yue W, Wang JP, Hamilton CJ, Demers LM, Santen RJ. In situ aromatization enhances breast tumor estradiol levels and cellular proliferation. Cancer Res 1998; 58: 927-32.
20. Haynes GJ, Dowsett AG, Lonning PE. Influence of letrozole (Femera) and anastrozole (Arimidex) on total body aromatization and plasma estrogen levels in postmenopausal breast cancer patients evaluated in a randomized cross-over study. J Clin Oncol 2002; 20: 751-7.
21. Bajetta E, Zilembo N, Bichisao E, Martinetti A, Buzzoni R, Pozzi P, et al. Tumor response and estrogen suppression in breast cancer patients treated with aromatase inhibitors. Ann Oncol 2000; 11: 1017-22.
22. Ailawadi RK, Jobanputra S, Kataria M, Gurates B, Bulun SE. Treatment of endometriosis and chronic pelvic pain with petrozole and norethindrone acetate: a pilot study. Fertil Steril 2004; 81(2): 290-6.
23. Shozu M, Murakami K, Segawa T, Kasai T, Inoue M. Successful treatment of symptomatic uterine leiomyoma with a non-steroidal aromatase inhibitor in a perimenopausal woman. Fertil Steril 2003; 79: 628-31.
24. Ellis MJ, Jaenicke F, Llombart-Cussac L. A randomized double-blind multicentre study of preoperative tamoxifen versus Femara (letrozole) for postmenopausal women with ER and/or PgR positive breast cancer ineligible for breast conserving surgery -correlation of clinical response with tumour gene expression and proliferation. Breast Cancer Res Treat 2000; 64: 29.
25. Fishman J, Bradlow HL, Schneider J, Anderson KE, Kappas A. Radiometric analysis of biological oxidations in man: sex differences in estradiol metabolism. Proc Natl Acad Sci 1980; 77: 4957-60.
26. Fishman J, Osborne MP, Telang NT. The role of estrogen in mammary carcinogenesis. Ann NY Acad Sci 1995; 768: 91-100.
27. Hulka BS, Stark AT. Breast cancer: cause and prevention. Lancet 1995; 346(8979): 883-7.
28. Kreiger N, Sloan M, Cotterchis M, Kirch V. The risk of breast cancer following reproductive surgery. Eur J Cancer 1999; 35: 97-101.
29. Broocks A, Pirke KM, Schweiger U, Tuschl RJ, Laessle RG, Strowitzki T, et al. Cyclic ovarian function in recreational athletes. J Appl Physiol 1990; (68): 2083-6.
30. Bullen BA, Skrinar GS, Beitins IZ, Von Mering G, Turnbull BA, McArthur JW. Induction of menstrual disorders by strenuous exercise in untrained women. N Engl J Med 1985; 312(21): 1349-53.
31. Feicht CB, Johnson TS, Martin BJ, Sparkes KE, Wagner WJr. Secondary amenorrhea in athletes. Lancet 1978; 2(8100): 1145-6.
32. Bernstein L, Henderson BE, Hanisch R, Sullivan-Halley J, Ross RK. Physical exercise and reduced risk of breast cancer in young women. J Natl Cancer Inst 1994; 86(18): 1403-8.
33. Thune I, Brenn T, Lunde E, Gaard M. Physical activity and the risk of breast cancer. N Engl J Med 1997; 336(18): 1269-75.
34. Beatson G. On the treatment of inoperable cases of carcinoma of the mamma: suggestions for a new method of treatment, with illustrative cases. Lancet 1896; 2: 104-7.
35. Thomas HV, Reeves GK, Key TJ. Endogenous estrogen and postmenopausal breast cancer: a quantitative review. Cancer Causes Control 1997; 8: 922-8.
36. Feigelson HS, Ross RK, Yu MC, Coetzee GA, Reichardt JK, Henderson BE. Genetic susceptibility to cancer from exogenous and endogenous exposures. J Cell Biochem Suppl 1996; 25: 15-22.
37. Sager R. Tumor-suppressor genes: The puzzle and the promise. Science 1989; 246(4936): 1406-12.
38. Miki Y, Swensen J, Shattuck-Eidens D, Futreal PA, Hershmann K, Tavtigian S, et al. A strong candidate for the breast and ovarian cancer susceptibility gene BRCA1. Science 1994; 266(5182): 66-71.
39. Wooster R, Bignell G, Lancaster J, Swift S, Seal S, Mangion J, et al. Identification of the breast cancer susceptibility gene BRCA2. Nature 1995; 378(6559): 789-92.
40. Bradlow HL. Nutrient modulation of female hormone metabolism: Modifying breast cancer risk. In: Functional Medicine Approaches to Endocrine Disturbances of Aging. Vancouver: British Columbia: Institute of Functional Medicine Proceedings, 2001: 100-14.
41. Bolton JL, Pisha E, Zhang F, Qiu S. Role of quinoids in estrogen carcinogenesis. Chem Res Toxicol 1998; 11(10): 1113-27.
42. Kabat GC, Chang CJ, Sparano JA, Sepkovie DW, Hu XP, Khalil A, et al. Urinary estrogen metabolitos and breast cancer: a case-control study. Cancer Epidemiol Biomarkers Prev 1997; 6(7): 505-9.
43. Davis DL, Telang NT, Osborne MP, Bradlow HL. Medical hypothesis: bifunctional genetic hormonal pathways to breast cancer. Environ Health Perspect 1997; 105: 571-6.
44. Swaneck GE, Fishman J. Covalent binding of the endogenous estrogen 16 alphahydroxyestrone to estradiol receptor in human breast cancer cells: characterization and intranuclear localization. Proc Natl Acad Sci USA 1988; 85: 7831-5.
45. Lustig R, Kendrick-Parker C, Jordan V. Effects of 16a-hydroxyestrone on MCF-7 cell proliferation and estrogen receptor regulation in vitro. Endocr Soc Proc 1994; 75: 317-20.
46. Meilahn EN, De Stavola B, Allen DS, Fentiman I, Bradlow HL, Sepkovic DW, et al. Do urinary oestrogen metabolites predict breast cancer? Guernsey III cohort follow-up. Br J Cancer 1998; 78: 1250-5.
47. Muti P, Bradlow HL, Micheli A, Krogh V, Freudenheim JL, Schunemann HJ, et al. Estrogen metabolism and risk of breast cancer: a prospective study of the 2:16alphahydroxy-estrone ratio in premenopausal and postmenopausal women. Epidemiology 2000; 11: 635-40.
48. Schneider J, Kinne D, Fracchia A, Pierce V, Anderson KE, Bradlow HL, et al. Abnormal oxidative metabolism of estradiol in women with breast cancer. Proc Natl Acad Sci USA 1982; 79: 3047-51.
49. Messina MJ. Legumes and soybeans: overview of their nutritional profiles and health effects. Am J Clin Nutr 1999; 70(3 Suppl): 439S-450S.
50. Barnes S. Phytoestrogens and cancer. Baillières Clin Endocrinol Metab 1998; 12: 559-79.
51. Lamartiniere CA. Protection against breast cancer with genistein: a component of soy. Am J Clin Nutr 2000; 71(6 Suppl): 1705S-1707S.
52. Adlercreutz H. Western diet and Western diseases: some hormonal and biochemical mechanisms and associations. Scand J Clin Lab Invest 1990; 201: 3-21.
53. Dai Q, Shu X-O, Jin F, Potter JD, Kushi LH, Teas J, et al. Population-based case-control study of soyfood intake and breast cancer risk in Shanghai. Br J Cancer 2001; 85: 372-87.
54. Wu AH, Ziegler RG, Nomura AMY, West DW, Kolonel LN, Horn-Ross PL, et al. Soy intake and risk of breast cancer in Asians and Asian Americans. Am J Clin Nutr 1998; 68(6 Suppl): 1437S-1443S.
55. Hadfield P. Japanese swallow Western diseases. New Scientist 1995; 2: 5-7.
56. Bernstein L, Yuan JM, Ross RK, Pike MC, Hanisch R, Lobo R, et al. Serum hormone levels in pre-menopausal Chinese women in Shanghai and white women in Los Angeles: results form two breast cancer case-control studies. Cancer Causes Control 1990; 1(1): 51-8.
57. MacMahon B, Cole P, Brown JB, Lin TM, Morgan RW, Woo NC. Urine oestrogen profiles of Asian and North American women. Int J Cancer 1974; 14(2): 161-7.
58. Chang YC, Riby J, Chang GH, Peng BC, Firestone G, Bjeldames LF. Cytostatic and antiestrogenic effects of 2-(indol-3-ylmethyl)-3,3′- diindolylmethane, a major in vivo product of dietary indole-3-carbinol. Biochem Pharmacol 1999; 58(5): 825-34.
59. Mori M, Tominaga T, Tamaoki BI. Steroid metabolism in normal mammary gland and in the dimethylbenzanthracene-induced mammary tumor of rats. Endocrinology. 1978; 102: 1387-97.
60. Bradlow HL, Sepkovic DW, Telang NT, Osborne MP. Indole-3-carbinol. A novel approach to breast cancer prevention. Ann N Y Acad Sci 1995; 768: 180-200.
61. Bradfield CA, Bjeldanes LF. Structure-activity relationships of dietary indoles: a proposed mechanism of action as modifiers of xenobiotic metabolism. J Toxicol Environ Health 1987; 21: 311-23.
62. Michnovicz JJ, Bradlow HL. Induction of estradiol metabolism by dietary indole-3- carbinol in humans. J Natl Cancer Inst 1990; 82: 947-9.
63. Bradlow HL, Sepkovic DW, Telang NT, Osborne MP. Multifunctional aspects of the action of indole-3-carbinol as an antitumor agent. Ann NY Acad Sci 1999; 889: 204-13.
64. Wong GY, Bradlow L, Sepkovic D, Mehl S, Mailman J, Osborne MP. Dose-ranging study of indole-3-carbinol for breast cancer prevention. J Cell Biochem Suppl 1997; 29: 111-6.
65. Cover CM, Hsieh SJ, Cram EJ, Hong C, Riby JE, Bjeldanes LF, et al. Indole-3-carbinol and tamoxifen cooperate to arrest the cell cycle of MCF-7 human breast cancer cells. Cancer Res 1999; 59: 1244-51.
66. Michnovicz JJ. Increased estrogen 2-hydroxylation in obese women using oral indole-3-carbinol. Int J Obes Relat Metab Disord 1998; 22: 227-9.
67. Terry P, Wolk A, Persson I, Magnusson C. Brassica vegetables and breast cancer risk. JAMA 2001; 285: 2975-7.
68. Michnovicz JJ, Naganuma H, Hershcopf RJ, Bradlow HL, Fishman J. Increased urinary catechol estrogen excretion in female smokers. Steroids 1988; 52: 69-83
.
69. Taioli E, Bradlow HL, Garbers SV, Sepkovic DW, Osborne MP, Trachman J, et al. Role of estradiol metabolism and CYP1A1 polymorphisms in breast cancer risk. Cancer Detect 1999; 23: 232-7.
70. Bradlow HL, Telang NT, Sepkovic DW, Osborne MP. 2-hydroxyestrone: the ‘good’ estrogen. J Endocrinol 1996; 150 Suppl: S259-S265.
71. Xu X, Duncan AM, Merz BE, Kurzer MS. Effects of soy isoflavones on estrogen and phytoestrogen metabolism in premenopausal women. Cancer Epidemiol Biomarkers Prev 1998; 7(12): 1101-8.
72. Xu X, Duncan AM, Wangen KE, Kurzer MS. Soy consumption alters endogenous estrogen metabolism in postmenopausal women. Cancer Epidemiol Biomarkers Prev 2000; 9(8): 781-6.
73. Lu LJ, Anderson KE, Grady JJ, Nagamani M. Effects of soya consumption for one month on steroid hormones in premenopausal women: implications for breast cancer risk reduction. Cancer Epidemiol Biomarkers Prev 1996; 5: 63-70.
74. Burow ME, Boue SM, Collins-Burow BM, Melnik LI, Duong BN, Carter-Wientjes CH, et al. Phytochemical glyceollins, isolated from soy, mediate hormonal effects through estrogen receptor á and â. J Clin Endocrinol Metab 2001; 86: 1750-8.
75. Morito K, Aomori T, Hirose T, Kinjo J, Hasegawa J, Ogawa S, et al. Interaction of phytoestrogens with estrogen receptors á and â (II). Biol Pharm Bull 2002; 25: 48-52.
76. An J, Tzagarakis-Foster C, Scharschmidt TC, Lomri N, Leitman DC. Estrogen receptor â-selective transcriptional activity and recruitment of coregulators by phytoestrogens. J Biol Chem 2001; 276: 17808-14.
77. Liu J, Burdette JE, Xu H, Gu C, van Breemen RB, Bhat KPL, et al. Evaluation of estrogenic activity of plant extracts for the potential treatment of menopausal symptoms. J Agric Food Chem 2001; 49: 2472-9.
78. Fioravanti L, Cappelletti V, Miodini P, Ronchi E, Brivio M, Di Fronzo G. Genistein in the control of breast cancer cell growth: insights into the mechanism of action in vitro. Cancer Lett 1998; 130: 143-52.
79. Frairia R, Fortunati N, Fazzari A, Fissore F, Comba A, Becchis M, et al. Sex steroid binding protein is a negative modulator of estrogen-induced breast cancer cell growth. Ann NY Acad Sci 1996; 784: 362-9.
80. Martin ME, Haourigui M, Pelissero C, Benassayag C, Nunez EA. Interactions between phytoestrogens and human sex steroid binding protein. Life Sci 1996; 58: 429-36.
81. Grube BJ, Eng ET, Kao Y-C, Kwon A, Chen S. White button mushroom phytochemicals inhibit aromatase activity and breast cancer cell proliferation. J Nutr 2001; 131: 3288-93.
82. Leung LK, Wang TT. BCL-2 is not reduced in the death of MCF-7 cells at low genistein concentration. J Nutr 2000; 130: 2922-6.
83. Pozo-Guisado E, Álvarez-Barrientos A, Mulero-Navarro S, Santiago- Josefat B, Fernández-Salguero PM. The antiproliferative activity of resveratrol results in apoptosis in MCF-7 but not in MDA-MB-231 human breast cancer cells: cell-specific alterations of the cell cycle. Biochem Pharmacol 2002; 64: 1375-86.
84. Tanos V, Brzezinski A, Drize O, Strauss N, Peretz T. Synergistic inhibitory effects of genistein and tamoxifen on human dysplastic and malignant epithelial breast cells in vitro. Eur J Obstet Gynecol Reprod Biol 2002; 102: 188-94.
85. Key TJ, Sharp GB, Appleby PN, Beral V, Goodman MT, Soda M, et al. Soya foods and breast cancer risk: a prospective study in Hiroshima and Nagasaki, Japan. Br J Cancer 1999; 81: 1248-56.
86. Trock BJ, White BL, Clarke R, Hilakivi-Clarke L. Meta-analysis of soy intake and breast cancer risk. J Nutr 2000; 130: 653S-680S.
87. Franke AA, Custer LJ, Tanaka Y. Isoflavones in human breast milk and other biological fluids. Am J Clin Nutr 1998Dic; 68(6 Suppl): 1466S-1473S.
88. Lamartiniere CA. Timing of exposure and mammary cancer risk. J Mammary Gland Biol Neoplasia 2002; 7(1):67-76.
89. Mousavi Y, Adlercreutz H. Enterolactone and estradiol inhibit each other’s proliferative effect on MCF-7 breast cancer cells in culture. J Steroid Biochem Mol Biol Mar 1992; 41(3-8): 615-9.
90. Haggans CJ, Hutchins AM, Olson BA, Thomas W, Martini MC, Slavin JL. Effect of flaxseed consumption on urinary estrogen metabolites in postmenopausal women. Nutr Cancer 1999; 33(2): 188-95.
91. Haggans CJ, Travelli EJ, Thomas W, Martini MC, Slavin JL. The effect of flaxseed and wheat bran consumption on urinary estrogen metabolites in premenopausal women. Cancer Epidemiol Biomarkers Prev 2000; 9: 719-25.
92. Spierto FW, Gardner F, Smith SJ. Evaluation of an EIA method for measuring serum levels of the estrogen metabolite 2-hydroxyestrone in adults. Steroids 2001; 66: 59-62.
93. Ziegler RG, Rossi SC, Fears TR, Bradlow HL, Adlercreutz H, Sepkovic D, et al. Quantifying estrogen metabolism: an evaluation of the reproducibility and validity of enzyme immunoassays for 2-hydroxyestrone and 16alpha-hydroxyestrone in urine. Environ Health Perspect 1997; 105: 607-14.
94. Kabat GC, Chang CJ, Sparano JA, Sepkovie DW, Hu XP, Khalil A, et al. Urinary estrogen metabolites and breast cancer: a case-control study. Cancer Epidemiol Biomarkers Prev 1997; 6: 505-9.
1 Arnold, S.F.; Klotz, D.M.; Collins, B.M,; Vonier, P.M.; Guillette Jr., L.J. and McLachlan, J.A. (1996): Synergistic activation of estrogen receptor with combinations of environmental chemicals. Science 272: 14891492.
2 2008-2009 ANNUAL REPORT | PRESIDENT’S CANCER PANEL
3 Kelsey J, Gammon M, John E. Reproductive factors and breast cancer. Epidemiol Rev. 1993;15(1):3647.
4 Vom Saal FS, Akingbemi BT, Belcher SM, Birnbaum LS, Crain DA, Eriksen M, et al. Chapel Hill bisphenol A expert panel consensus statement: integration of mechanisms, effects in animals and potential to impact human health at current levels of exposure. Reprod Toxicol. 2007 Aug-Sep;24(2):1318.








Muy buen texto pero creo que os falta poner la fuente más importante desde donde habéis «copiado literalmente» toda la información.
5 cosas que necesitas saber. Soraya Llevo 3 semanas usando ecoslim y.no he notado nada en mi peso ni figura, si q es verdad que me reduc. El Consejo Escolar de Canarias pide garantizar tres comidas a todo el alumnado. Бlvaro Martнn y Marнa Pйrez dan a Espaсa un doblete de oro histуrico. Vнa libre al plan de modernizaciуn de Callao Salvaje, La Caleta y Playa Paraнso. Hay momentos en los que, de repente, nos damos cuenta de que hemos cogido peso y es entonces cuando tomamos la decisión de ponernos a dieta. http://ecoslim-in-spain.com/#5 La imagen de Carlota Corredera, utilizada en un fraude de productos adelgazantes (Instagram) En el anuncio falso, Carlota daba las gracias a su compañero por evaluar de forma tan positiva “mis logros en todo este tiempo” . De hecho, explicaba que las gotas “son utilizadas por los atletas en el período de secado, y su eficacia en la lucha contra la grasa son pocos los que se niegan. Se reduce el novel de colesterol en la sangre y contribuye a una mejora del metabolismo” .
Gracias a ella, las pastillas tienen un efecto favorable sobre la hipopotasemia (deficiencia de oxígeno constante en la sangre) que en realidad es la principal causa de la hipertensión arterial. Gracias a su composición patentada, el producto es absolutamente inofensivo para su uso y se vende sin receta. Se puede tomar libremente por cualquier persona que sufre de los síntomas de este problema de salud. Para más información, visite el sitio web oficial Recardio. http://gipertofort.site/es ReCardio es una combinación de varios componentes, cada uno de los cuales aporta una determinada propiedad a la preparación. Rhodiola rosea . El extracto de esta flor reduce el riesgo de aterosclerosis y ayuda a eliminar las placas de colesterol que obstruyen los vasos. La cúrcuma . Spice, que ayuda a mantener los vasos en un tono, al fortalecer sus paredes.
Hola … siempre me sale acné antes de la menstruación… ya entiendo porque… aunque es muy molesto por otro lado me avisa que ya viene para prepararme…
https://saludybienestar1223.wordpress.com/
hola
tengo 55 años y a pesar de ir haciendo años, considero que más coquetas deberemos ser, como está mandado
bueno yo ahora estoy teniendo un problema no de la tiroide, si no en la paratiroide puedes algo relacionado con la vitamina D baja y el calcitrol alto
haber si me empiezan a controlar.
mientras tanto ya llevo como nueve meses con acné rosácea y piel mixta grasa
me he puesto tratamientos de estética
conocí un día a una vecina, que me voy muy acomplejada y muy mal moralmente, pues no et para menos
entonces no dió a probar unos productos vuestros naturales
es gel de áloe verá sala limpieza de cara.
en noche me hecho áloe verá puro, y en los granitos árbol de té con bastón de los oídos
luego por la mañana, de nuevo mi limpieza, y me lealmente aceite de lavanda con cinco gotas de rosa mosqueta
pues no noto la piel mucho más calmada y estoy muy contenta.
Creo tener un problema con la menopausia y las plaquetas este relacionado
Marian de Madrid, he estado con terrible HPV y asma durante 65 años y ¡Doctor dijo que no tiene cura! Realmente estaba pasando un mal momento … Creí el increíble poder curativo … Él está aquí y experimenta un toque … Usé la Unción de aceite y agua bendita … Es gratis … Solo pago por el servicio de mensajería (servicio postal) .. Nunca he visto tanto poder, esas cosas en mi vida … AWESOMEHEALINGPOWER@GMAIL.COM
He usado medicamentos de Herb y English, ambos me fallaron … ¿No funcionaron?
Solo un toque de Unno Oil y Holy Water de PST. Me curé, estoy totalmente libre de VPH y asma …
Esta es la verdadera experiencia de la historia de la vida lo mismo! ser liberado de enfermedades, ataques espirituales, esterilidad_, infertilidad_ matrimonios rotos, buscar compañeros de vida y toda forma de vida retrocedida @ AWESOMEHEALINGPOWER @ GMAIL.COM
EXCELENTE ARTÍCULO. FELICITACIONES Y GRACIAS POR COMPARTIRLO.
mil gracias perdí a mi bebé hace 2 días tenía 7 semanas de embarazo, embarazo que no fue fácil lograr ya que tengo ausencias mestruales del período muy prolongadas, tengo 11años con tiroides nunca me he sentido que mi tratamiento elimine mi depresión ni mi aumento de peso apesar de hacer ejercicio y dieta, mis brazos tienen mucho músculo tengo bigote y brotes de barba ahora entiendo porque y tbnm xq mi bb no pudo desarrollarse dentro de mi. gracias su información me concientiza y tranquiliza.
Excelente información
GRACIASS HASTA Q AL FIN PUDE DESCUBRIR LA CAUSA DE MI DEPRESION, A CAUSA DEL ACNE, LLEVO MAS DE 10 AÑOS BUSCANDO RESPUESTA A MI PROBLEMA HORMONAL
Está información no es tan beneficiosa puesto que depende demasiado de un buen diagnóstico médico para el respectivo tratamiento y medicación pues varía según El paciente o persona